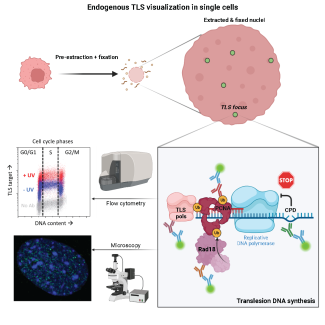
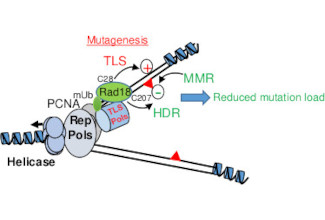
L'équipe s'intéresse en général à la régulation de la réponse aux dommages à l'ADN (DNA Damage response ou DDR), et en particulier à sa régulation au cours du développement embryonnaire. La fonction de la DDR est de ralentir ou bloquer le cycle cellulaire si l'ADN présente des lésions (cassure des brins, intégrité des télomères, arrêt de la synthèse d'ADN) afin d’empêcher la prolifération cellulaire en présence d'ADN endommagé et de ce fait, éviter la propagation de mutations qui sont à la base de l'instabilité génomique. Une forte instabilité génomique est caractéristique de la plupart des cancers (fusions télomèriques, translocations, duplications et délétions). Aujourd'hui on pense que la majorité des tumeurs sporadiques sont dues à des mutations dans des gènes participant à la DDR, ce qui aboutit également à la prédisposition à des maladies génétiques. De ce fait, la DDR joue un rôle clé dans le maintient de la stabilité du génome et fonctionne comme un barrière à la transformation maligne.