De plus en plus d’arguments plaident en faveur de l’existence d’un lien causal entre une activation prolongée du système immunitaire et le développement de maladies chroniques comme l’athérosclerose, le syndrome metabolique et le diabète de type 2, la stéatose hépatique, les troubles neurocognitifs, l’ostéoporose, la fragilité et même certains types de cancer.
L’infection par le VIH est un bon modèle pour étudier ces liens. Notre groupe travaille sur l’activation immunitaire chronique, ses causes et ses conséquences, chez les personnes vivant avec le VIH avirémiques sous traitement, appelées répondeurs virologiques. Notre hypothèse de travail est que les répondeurs virologiques pourraient présenter différents profils d’activation immunitaire que nous souhaitons caractériser. Chacun de ces profils d’activation immunitaire pourraient être causé par des facteurs étiologiques propres, comme la persistance d’une production rétrovirale ou d’une lymphopénie T4, une translocation microbienne, des coinfections, une immunosénescence, et/ou une dérégulation de l’équilibre Th17/Treg. Par ailleurs chacun de ces profils immunitaires pourrait favoriser la survenue de comorbidités spécifiques.
En plus de faciliter l’émergence de maladies chroniques, la suractivité du système immunitaire durant des années semble entraver la restauration du pool des cellules T4. Nous étudions comment une forme particulière d’activation monocytaire pourrait être impliquée dans ce phénomène.
Un autre problème pour les répondeurs virologiques est la persistance du génome rétroviral dans ce qu’il est convenu d’appeler des cellules réservoirs. Cette persistance empêche l’éradication du VIH. C’est pourquoi la communauté scientifique est à la recherche de molécules capables de forcer les cellules réservoirs à produire des particules virales dans le but de provoquer leur destruction. A la suite d’un screening systématique des récepteurs couplés aux protéines G (GPCR) coexprimés avec le corécepteur CCR5 dans les cellules T4, nous avons identifié des GPCR présents à la surface de cellules réservoirs dont l’activation déclenche une production virale.
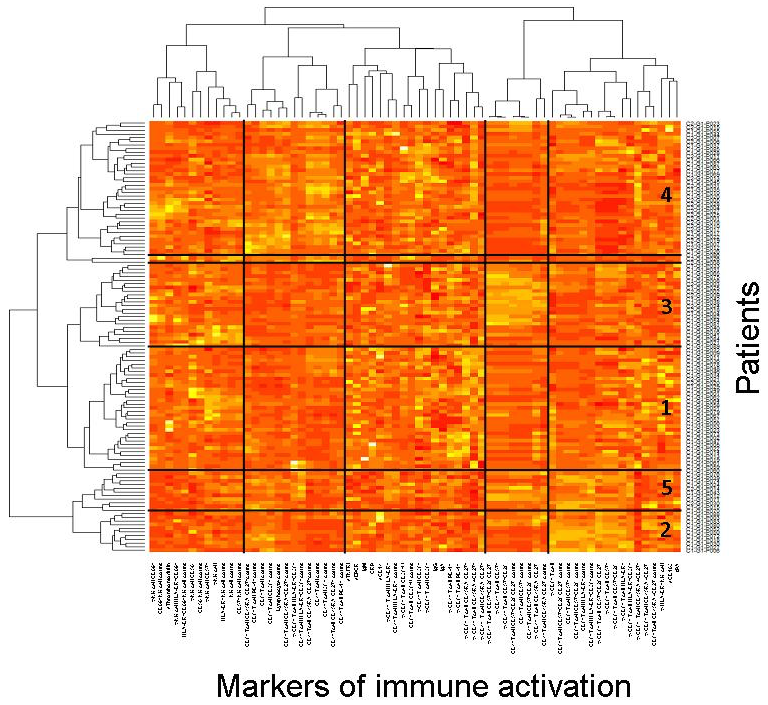
Figure 1. Virologic responders present with different immune activation profiles. Heatmap showing the hierarchical clustering of the activation markers (vertical) as well as of the virologic responders according to their profile of activation (horizontal). Each Profile number is indicated
Collaborations
- Division of Hematology, McGill University Health Center, Montréal, Québec, Canada
- Département des Maladies infectieuses et immunitaires, CHU Laval, Québec, Canada
- INSERM U1065, Nice, France
- Sorbonne Universités, UPMC Université Paris 06, INSERM, Institut Pierre Louis d’Epidémiologie et de Santé Publique (IPLESP UMRS 1136), Paris, France
- Hôpital Saint-Antoine, Département de Santé Publique, AP-HP, Paris France
- Université Paris Descartes, Sorbonne Paris Cité; AP-HP, CIC Cochin Pasteur, Hôpital Cochin, Paris, France
- INSERM, CIC 1417, Paris, F-CRIN, I–REIVAC, France