Projet : Régulation de la stabilité du génome au cours du développement embryonnaire
La DDR est inefficace pendant les premières étapes du développement embryonnaire. Les raisons de cette régulation et ses bases moléculaires ne sont pas bien comprises. Nous avons exploré cette problématique chez les embryons précoces de la mouche Drosophila melanogaster (drosophile), l’amphibien Xenopus laevis (xénope) et chez les cellules souches embryonnaires de souris (cellules ES).
Chez le xénope nous avons découvert que la DDR est inefficace car les embryons contournent de façon très efficace les lésions de l’ADN par l’activation constitutive de la synthèse d’ADN translésionnelle (TLS). Cette régulation empêche l’arrêt de la synthèse d’ADN devant les lésions et par conséquent l’activation de la DDR. Ceci est dû à l’expression élevée du régulateur majeur de la TLS, l’ubiquitine ligase Rad18, pendant les premiers cycles de divisions embryonnaires (Figure 1). Son niveau décline ensuite à des étapes plus tardives, avant l’activation de la transcription du zygote, la transition de mid-blastula (MBT ; Kermi et al., Dev Cell 2015). Nous avons exploré les conséquences de l’activation constitutive de la TLS sur la stabilité du génome au cours du développement embryonnaire. Nous avons mis en évidence un taux de mutation très élevé ainsi que la présence de gros réarrangements de l’ADN qui dépendent de la TLS. Nous avons aussi déterminé les conséquences des mutations accumulés pendant l’embryogenèse précoce sur le développement chez la drosophile. Nous avons trouvé que l’absence de l’ADN polymérase TLS Pol eta pendant les étapes les plus précoces du développement embryonnaire engendre une réduction de la viabilité des larves, et chez les adultes se traduit dans une diminution de la variabilité génétique au niveau de la chromatine péricentromérique. Nous avons aussi trouvé que la signature mutagènique de la TLS Pol eta que nous avons identifié chez la drosophile est similaire à celle identifiée chez certains cancers humains (Figure 2, Lo Furno et al., Nucleic Acids Research, sous presse). Ceci constitue un nouveau mécanisme de variation génétique opérant au cours du développement très précoce qui contribue au polymorphisme génétique individuel et pourrait expliquer la prédisposition à développer le cancer. Ces découvertes ouvrent également la voie à la compréhension des bases moléculaires de l'instabilité du génome observée chez les embryons humains.
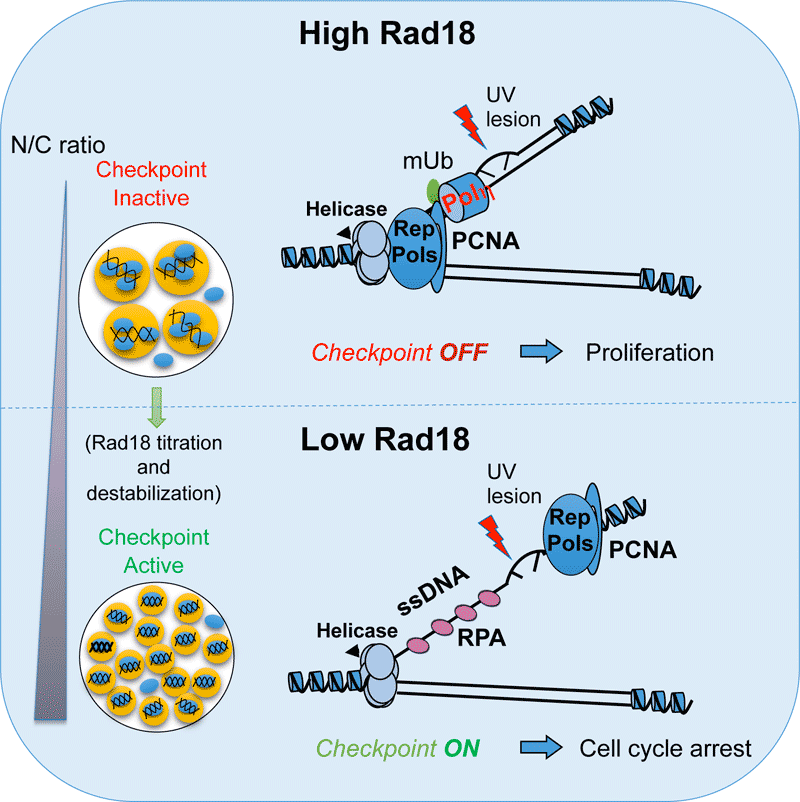
Figure 1. L’activation constitutive de la translésion inhibe l’activation de la DDR pendant l’embryogenèse précoce du xénope. (Adapté de Kermi et al., Dev Cell 2015).
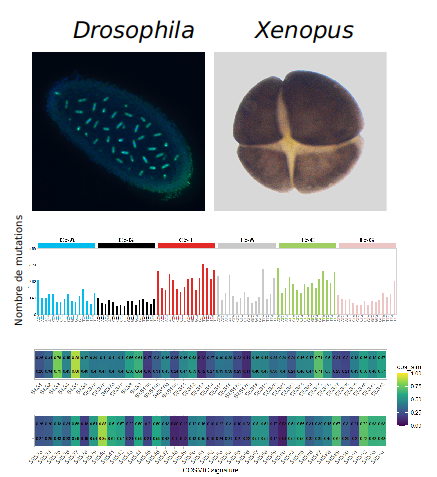
Figure 2. Panel supérieur: embryons très précoces de drosophile et de xénope. Panel du milieu, spectre de mutations embryonnaires générées par TLS Pol eta. Panel du bas: carte de similarité entre le spectre de mutations de TLS Pol eta et celui de cancers humains identifié dans la banque de données COSMIC.
Les cellules souches embryonnaires de souris (ES) sont également caractérisées par une faible activation de la DDR, au niveau du checkpoint de la transition entre la phase G1 et S du cycle cellulaire. De ce fait les cellules ES montrent plusieurs signes d’instabilité génomique. Nous avons découvert que l’inhibition de ce checkpoint est dû à la stabilisation de la protéine phosphatase CDC25A, un régulateur majeur de la transition G1/S (Figure 2). Nous avons aussi identifié son régulateur, l’ubiquitine hydrolase Dub3 et montré que son expression est sous contrôle de deux facteurs de pluripotence, Esrrb et Sox2 (van der Laan et al., Mol Cell 2013). Nous voudrions maintenant comprendre les bases moléculaires de l’instabilité génomique observée chez les cellules souches embryonnaires et les cellules pluripotentes induites (iPSs) afin de pouvoir améliorer leur utilisation en médecine régénérative.
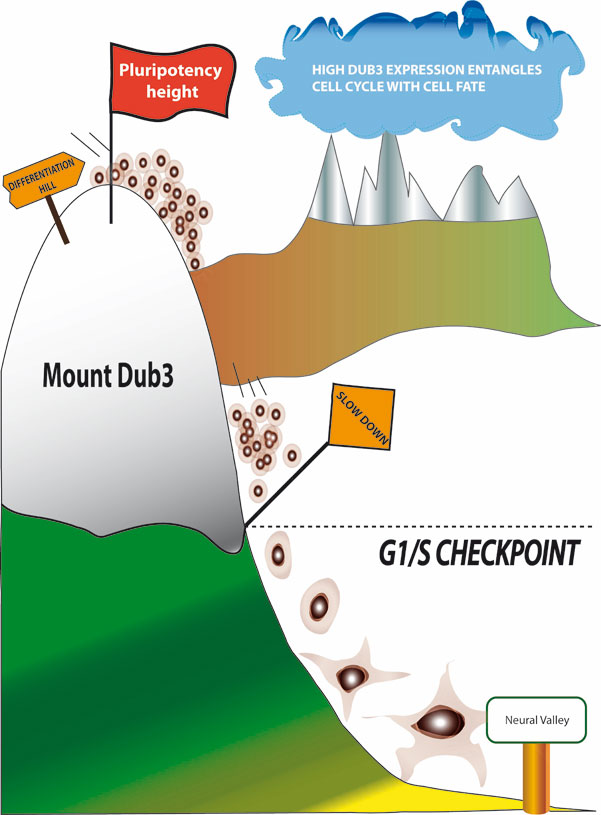
Figure 3. Le niveau d’expression de Dub3 dans les cellules souches embryonnaires de souris contrôle le checkpoint de G1/S et l’état pluripotent.

