TPR is required for cytoplasmic chromatin fragment formation during senescence
Bethany M Bartlett, Yatendra Kumar, Shelagh Boyle, Tamoghna Chowdhury, Andrea Quintanilla, Charlene Boumendil, Juan Carlos Acosta, Wendy A Bickmore
Dans les cellules eucaryotes, le matériel génétique - l'ADN - stocké dans le noyau est confronté à deux défis majeurs : (i) il existe différents sous-compartiments dans le noyau (ii) il est organisé en un complexe nucléo-protéique sous forme de chromatine. Ces deux aspects peuvent potentiellement contribuer à moduler toutes les fonctions du génome.
Notre laboratoire s'intéresse à comprendre comment ces deux aspects de l'architecture nucléaire (compartiments nucléaires et organisation de la chromatine) coopèrent pour permettre la régulation des fonctions de l'ADN telles que la réparation de l'ADN ou l'expression des gènes. Par exemple, alors que la lamina s'associe généralement à de la chromatine compacte, appelée hétérochromatine, les pores nucléaires sont toujours dépourvus d'association avec l'hétérochromatine. Nous avons récemment montré que l'augmentation de la densité des pores nucléaires peut déclencher des réarrangements chromatiniens majeurs pendant la sénescence cellulaire, ce qui est corrélé avec l'expression d'un réseau de gènes inflammatoires spécifique.
Nous utilisons une variété d'approches, notamment la biologie cellulaire et moléculaire, des méthodes d'imagerie avancées et la biologie synthétique dans divers modèles cellulaires, dont la sénescence cellulaire et les cellules souches embryonnaires de souris.
Plus précisément, les questions que nous posons actuellement dans le laboratoire sont les suivantes :
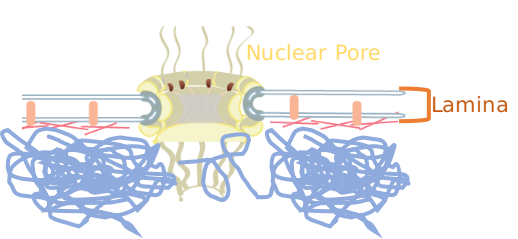
Figure 1- Les pores nucléaires et la lamelle nucléaire sont deux compartiments nucléaires distincts formant l'enveloppe nucléaire. Alors que la lamelle nucléaire s'associe à l'hétérochromatine compacte, les pores nucléaires sont toujours dépourvus d'association avec l'hétérochromatine.
Bethany M Bartlett, Yatendra Kumar, Shelagh Boyle, Tamoghna Chowdhury, Andrea Quintanilla, Charlene Boumendil, Juan Carlos Acosta, Wendy A Bickmore
Nobari P, Doye V, Boumendil C
Gabrielle Olley, Madapura M. Pradeepa, Graeme R. Grimes, Sandra Piquet, Sophie E. Polo, David R. FitzPatrick, Wendy A. Bickmore, Charlene Boumendil
Deniaud E, Lemaître C, Boyle S, Bickmore WA
Lemaître C, Bickmore WA
Lemaître C, Soutoglou E
Lemaître C, Grabarz A, Tsouroula K, Andronov L, Furst A, Pankotai T, Heyer V, Rogier M, Attwood KM, Kessler P, Dellaire G, Klaholz B, Reina-San-Martin B, Soutoglou E
Theil AF, Nonnekens J, Steurer B, Mari PO, de Wit J, Lemaitre C, Marteijn JA, Raams A, Maas A, Vermeij M, Essers J, Hoeijmakers JH, Giglia-Mari G, Vermeulen W
C Lemaître, B Fischer, A Kalousi, A-S Hoffbeck, J Guirouilh-Barbat, O D Shahar, D Genet, M Goldberg, P Betrand, B Lopez, L Brino & E Soutoglou
Corpet A, De Koning L, Toedling J, Savignoni A, Berger F, Lemaître C, O\'Sullivan RJ, Karlseder J, Barillot E, Asselain B, Sastre-Garau X, Almouzni G
De Koning L, Savignoni A, Boumendil C, Rehman H, Asselain B, Sastre-Garau X, Almouzni G
Pankotai T, Hoffbeck AS, Boumendil C, Soutoglou E